
呼吸机是一种能够起到预防和治疗呼吸衰竭,减少并发症,挽救及延长病人生命的至关重要的医疗设备。
在现代临床医学中,呼吸机作为一项能人工替代自主通气功能的有效手段,已普遍用于各种原因所致的呼吸衰竭、大手术期间的麻醉呼吸管理、呼吸支持治疗和急救复苏中,在现代医学领域内占有十分重要的位置。
呼吸器等医疗器械对冠病患者至关重要,当一名患者的肺部因充满液体而难以向血液供氧时,是否有呼吸机辅助呼吸,可决定患者的生死;
01
出口通关要求
商品归类
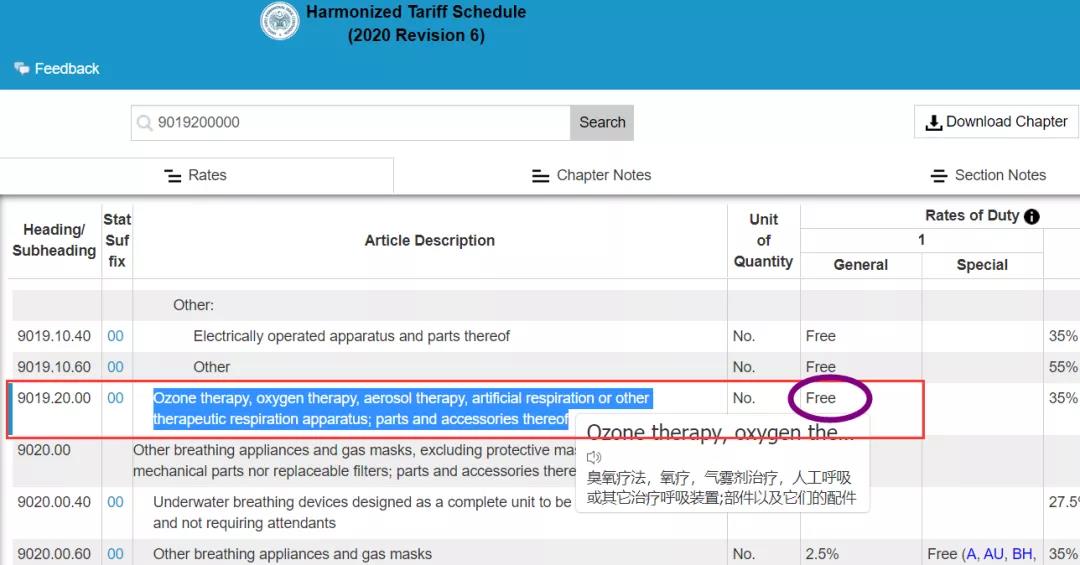
| 商品
|
说明
|
商品编号
|
| 呼吸机
|
臭氧治疗器、氧气治疗器、喷雾治疗器、人工呼吸器或其他治疗用呼吸器具
|
9019.2000
|
禁限管理
根据商务部 海关总署 国家药品监督管理局2020年第5号公告,须提供书面或电子声明,承诺出口产品已取得我国医疗器械产品注册证书,符合进口国(地区)的质量标准要求。(详情参照今日Mike外贸说次头条文章“口罩出口出新规,商务部、海关总署、药监局联合官宣”)
目前具有呼吸机出口资质的企业名单如下:
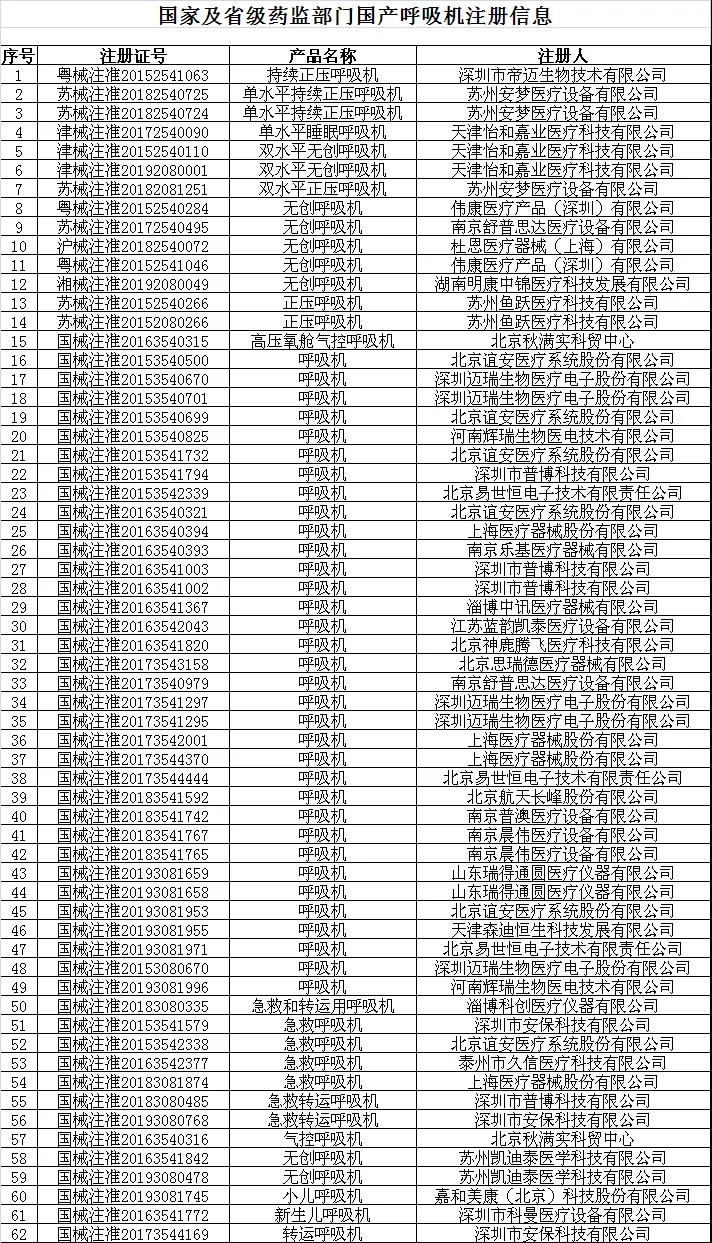
*该名单在国家药监局网站动态更新。
国家药监局网站动态更新查询地址:
http://www.nmpa.gov.cn/WS04/CL2582/

退税管理
↓↓↓以下内容是根据国内外相关政府机构、↓↓↓
专业网站、新闻报道收集整理而成,
仅供参考。具体内容以相关管理部门、
国外官方机构要求为准。
相关货物出口时,中国海关无下列相关证件要求。
02
各国呼吸机准入条件

想要验证的朋友可以打开https://hts.usitc.gov/,输入呼吸机海关编码9019200000,便能看到结果:
1.申请函
此部分应包括申请人(或联系人)和企业的基本信息、FDA 510(K)递交的目的、申请上市器械的名称型号和分类资料、进行实质等效比较的产品(Predicate Device)名称及其510(k)号码。
即FDA 510(k)文件中所含全部资料的清单(包括附件)。
3.真实性保证声明
FDA有一个标准的样本
4.器材名称
即产品通用名、FDA分类名、产品贸易名。
5.注册号码
如企业在递交FDA 510(k)时已进行企业注册,则应给出注册信息,若未注册,也予注明。
6.分类
即产品的分类组、类别、管理号和产品代码。
7.性能标准
产品所满足的强制性标准或自愿性标准。
8.产品标识
包括企业包装标识、使用说明书、包装附件、产品标示等。
9.实质相等性比较(SE)
选择合适的产品进行比较是510(K)申请的关键步骤。在进行比较时应从如下方面进行考虑:企业必须提供充足的资料证明,所申请上市的器械和被比较的器械是实质相等的(SE),否则510(k)申请不会通过。
10.510(k)摘要或声明
申请文件摘要和支持等价器械的结论。
11.产品描述
包括产品的预期用途、工作原理、动力来源、零组件、照片、工艺图、装配图、结构示意图等。
12.产品的安全性与有效性
包括各种设计、测试资料。
13.生物相容性
生物相容性是指材料与生物体之间相互作用后产生的各种生物、物理、化学等反应的一种概念。一般地讲,就是材料植入人体后与人体相容程度,也就是说是否会对人体组织造成毒害作用。
14.色素添加剂(如适用)
15.软件验证(如适用)
16.灭菌(如适用)
包括灭菌方法的描述、灭菌验证产品包装和标识等。
● 技术标准简析
需特别注意的是,美标中要求婴儿呼吸机工作压力控制应在整个范围内精确至 ±2cm H2O,而其他呼吸机应精确至±5cm H2O。与美标相比,国标没有按照婴儿呼吸机和其他呼吸机进行要求,要求读数的精度为± (2%满刻度+4%实际读数)。另外就是国标对报警声音的要求是最新执行的标准,而美国的设备是按照声称的标准进行测试。
欧盟
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=13
2.自2020年5月26日起,MDR (EU) 2017/745医疗器械法规将正式取代欧盟现行的MDD医疗器械指令强制实施,同样在欧盟官网可以查询到。
欧盟官网MDR (EU) 2017/745医疗器械法规授权的机构查询地址:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=34
特别提醒:2020年5月26号施行的欧盟MDR对目前CE认证MDD而言有哪些影响?
如果需要投放市场产品必须满足日本的Pharmaceutical and Medical Device Act (PMD Act),在PMD Act的要求下,TOROKU注册系统要求国外的制造商必须向PMDA注册制造商信息。
韩国
澳大利亚
特别提醒:澳大利亚已与欧盟达成互认协议。这意味着,合格评定证书由TGA颁发的也被欧盟认可,TGA也认可欧盟CE认证。已获CE认证的用户,可提交CE证书及相关资料,获得TGA证书。
如果产品已经注册或备案,制造商更换经销商对其没有影响。对国外产品进行注册审批后,每年还要常规注册一次,说明产品型号、性能及质量有无变化。TGA 全权负责对医疗器械的符合性评价,并收取一定费用,相关费用金额可参见 TGA的网站。
TGA网址:https://www.tga.gov.au/
03
各国呼吸机技术标准简析
|
国家(地区) |
标准号 |
标准名称 |
|
美国 |
ANSI/ASTM/IEC 60601.2.12-2009 |
医用电气设备 第2-12部分:肺呼吸机的特殊安全性要求.ASTM国际标准容许偏差的重症监护呼吸机 |
|
ANSI/ASTM/ISO 10651-4-2002 |
医用肺呼吸机 第4部分:操作员控制用人工呼吸机的特殊要求 |
|
|
ANSI/ASTM/ISO 10651-5-2006 |
医用肺呼吸机 基本安全和基本性能的特殊要求.第5部分:气动急救人工呼吸器 |
|
|
ANSI/NFPA 1981-2006 |
救火和急救服务用开路自持呼吸机标准 |
|
|
ASTM ANS/IEC 60601-2-12-2001 |
医用电气设备 第2-12部分:呼吸机安全特定要求-急救用呼吸机-经ASTM国际批准作为带差异的美国国家标准 |
|
|
ANSI/ASTM/ISO 10651-4-2ASTM ANS/IEC 60601.2.12-2001 |
医疗电气设备 第2-12部分; 肺通气器安全特别要求—关键护理呼吸机通过美国国家标准认证,偏差符合ASTM国际标准 |
|
|
ASTM ANSI/ISO 10651-4-2002 |
呼吸机 |
|
|
ASTM ANSI/ISO 10651-5-2006 |
医用呼吸机 基本安全和基本性能的特定要求 |
|
欧盟 |
EN 794-3-2009 |
肺呼吸机 第3部分:紧急呼吸机和运输呼吸机的特殊要求 |
|
EN ISO 80601-2-12-2011 |
医用电气设备 第2-12部分:危重护理呼吸机的基本安全和基本性能专用要求 |
|
|
EN ISO 80601-2-72-2015 |
医疗电气设备 第2-72部分:对呼吸机依赖患者的家庭医疗保健环境通风机基本安全和基本性能的特殊要求 |
|
|
EN 14048-2002 |
包装 测定在气化介质中包装材料的最终氧化生物降解性 封闭式呼吸机氧量测量方法 |
|
|
EN 14529-2005 |
呼吸保护装置 逃生用包含由需求阀控制的正压呼吸器的带半罩式面具的自持式开路压缩空气呼吸机 |
|
|
EN 60601-2-12-2006 |
医用电气设备 肺呼吸机安全性特定要求.第2-12部分:危急护理呼吸机 |
|
日本 |
JIS T 7204:1989 |
医疗用人工呼吸机 |
|
韩国 |
KS C IEC 60601-2-12-2011 |
医用电气设备 肺通气机安全性的特定要求.第2-12部分:危急护理通气机 |
|
澳大利亚 |
EN 794-3-2009 |
肺呼吸机 第3部分:紧急呼吸机和运输呼吸机的特殊要求 |
|
EN ISO 80601-2-12-2011 |
医用电气设备 第2-12部分:危重护理呼吸机的基本安全和基本性能专用要求 |
|
|
EN ISO 80601-2-72-2015 |
医疗电气设备 第2-72部分:对呼吸机依赖患者的家庭医疗保健环境通风机基本安全和基本性能的特殊要求 |
|
|
EN 14048-2002 |
包装 测定在气化介质中包装材料的最终氧化生物降解性 封闭式呼吸机氧量测量方法 |
|
|
EN 14529-2005 |
呼吸保护装置 逃生用包含由需求阀控制的正压呼吸器的带半罩式面具的自持式开路压缩空气呼吸机 |
|
|
EN 60601-2-12-2006 |
医用电气设备 肺呼吸机安全性特定要求.第2-12部分:危急护理呼吸机 |
|
俄罗斯 |
GOST R ISO 80601-2-12-2013 |
医疗电气设备. 第2-12部分. 重症监护呼吸机基本安全和基本性能的特殊要求 |
|
国际标准 |
ISO 10651-6-2004 |
医用肺通气机 基本安全和主要性能的特殊要求 第6部分:家用呼吸机辅助设备 |
|
ISO 80601-2-12-2011 |
医疗电气设备.第2-12部分:急救护理呼吸机的基本安全性和本质性能的详细要求 |
|
|
ISO 80601-2-72-2015 |
医疗电气设备. 第2-72部分: 对呼吸机依赖患者的家庭医疗保健环境通风机基本安全和基本性能的特殊要求 |
*以上技术标准为各国进口或销售时,由各国海关或相关部门要求验核;如有动态调整,以相关标准管理机构官方发布为准,仅作为提醒或参考资料。
来源:Mike外贸说综合自12360海关热线